Leçons élémentaires de chimie/8
CHAPITRE VIII
ANHYDRIDE OU GAZ CARBONIQUE, CO2
ACIDE CARBONIQUE, CO3H2
29. Caractères du gaz carbonique.
1° Le gaz carbonique trouble l’eau de chaux ;
2° Comme l’azote, il n’entretient ni la respiration, ni la combustion ; une bougie allumée s’éteint si on l’introduit dans une éprouvette de ce gaz.
30. Propriétés du gaz carbonique.
I. DENSITÉ
Le gaz carbonique est plus lourd que l’air. On le montre par plusieurs expériences :
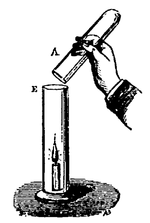
1° Plaçons une bougie allumée au fond d’une éprouvette à pied, et inclinons au-dessus une éprouvette pleine de gaz carbonique (fig. 36), le gaz tombe sur la flamme et l’éteint ;
2° Nous remplissons de gaz carbonique une large éprouvette, puis nous la retournons ; nous gonflons d’air une bulle de savon, et nous l’abandonnons au-dessus de éprouvette ; elle tombe, puis rebondit quand elle rencontre la couche de gaz carbonique.
Il résulte de cette grande densité que le gaz carbonique dégagé de certaines fissures du sol reste accumulé à sa surface. C’est ce qui arrive dans la grotte du chien, près de Naples ; un homme y respire librement, mais un chien ou un animal de petite taille qu’on y fait entrer est plongé tout entier dans la couche de gaz carbonique, et meurt si on le laisse y séjourner quelque temps.
II. DISSOLUTION DANS L’EAU
Le gaz carbonique existe à l’état de dissolution dans certains liquides tels que l’eau de Seltz, le cidre mousseux, le vin de Champagne, qui lui doivent leur saveur aigrelette. Il ne se dissout dans l’eau en quantité notable que s’il est fortement comprimé ; aussi doit-on employer, pour conserver ces liquides, des flacons très solides et très fortement bouchés. Lorsqu’on débouche une bouteille de vin de Champagne, le gaz s’échappe en partie et fait mousser le liquide. Le même fait se produit avec l’eau de Seltz, au moment où on établit, au moyen d’un dispositif quelconque, la communication de l’air avec l’atmosphère intérieure du flacon ; la pression du gaz fait monter l’eau dans le tube central (fig. 37).

Le gaz carbonique, dissous par l’eau de pluie, joue un rôle important au point de vue géologique. Recommençons l’expérience qui permet de caractériser le gaz carbonique ; dans un verre contenant de l’eau de chaux, nous faisons plonger le tube abducteur de l’appareil qui sert à préparer le gaz carbonique ; l’eau de chaux se trouble d’abord, il s’est formé du carbonate de calcium, insoluble dans l’eau. Continuons l’expérience, le liquide redevient limpide ; donc le calcaire est soluble dans l’eau chargée de gaz carbonique. On comprend ainsi que l’eau de pluie, après avoir dissous le gaz carbonique en traversant l’air, puisse dissoudre les calcaires du sol. Quand cette eau revient à la surface, elle perd du gaz carbonique qui se dégage ; le calcaire, redevenu insoluble, se dépose ; s’il est abondant, il donne lieu aux incrustations que forment les sources pétrifiantes sur les objets qu’on y plonge, aux stalactites et stalagmites (fig. 38). C’est à cause du dégagement de gaz carbonique qu’une eau chargée de calcaire se trouble quand on la fait bouillir ; quand on fait journellement chauffer de l’eau dans un même appareil, le dépôt de carbonate de calcium produit, en s’accumulant, une véritable incrustation pierreuse (bain-marie, chaudières de machines à vapeur).

III. ACIDE CARBONIQUE
La dissolution du gaz carbonique colore la teinture bleue de tournesol en rouge vineux ; cette action est produite par l’acide carbonique résultant de la combinaison du gaz carbonique et de l’eau
On n’a pas réussi encore à préparer la combinaison CO3H2, mais on connaît les sels qui y correspondent, par exemple le carbonate de potassium CO3K2.
31. Préparation du gaz carbonique.
1° Nous avons vu qu’on obtient le gaz carbonique en brûlant du charbon dans l’air ou dans l’oxygène : ce procédé n’est pratiqué que dans l’industrie ;
2° Si on verse un acide sur du calcaire, le gaz carbonique se dégage avec une sorte de bouillonnement qu’on appelle effervescence. On utilise cette réaction pour le préparer. On fait agir sur la craie ou le marbre blanc, cassés en petits fragments, l’acide chlorhydrique additionné d’eau ; le calcium se substitue à l’hydrogène de l’acide pour former du chlorure de calcium, soluble dans l’eau :
L’appareil dans lequel on effectue cette réaction est identique à celui qui a servi à la préparation de l’hydrogène (fig. 39).

Dans l’industrie, pour la fabrication de l’eau de Seltz, on emploie la craie et l’acide sulfurique qui sont tous deux d’un prix peu élevé. Il se forme alors du sulfate de calcium :
Le sulfate de calcium (plâtre) est insoluble dans l’eau, il se dépose sur la craie et la préserve de l’action de l’acide ; le dégagement de gaz cesserait si l’on n’agitait constamment pour empêcher le dépôt.