Leçons élémentaires de chimie/15
CHAPITRE XV
LES ACIDES USUELS
49. Caractère des acides.
Nous savons qu’on reconnaît les acides à leur propriété de colorer en rouge la teinture bleue de tournesol.
Trois acides sont fréquemment employés :
| L’acide azotique, | AzO3H. |
| L’acide sulfurique, | SO4H2. |
| L’acide chlorhydrique, | HCl. |
Ce sont des acides énergiques ; ils colorent fortement la teinture de tournesol.
50. Caractère de l’acide azotique.
L’acide azotique est un liquide qui dissout le cuivre ; il se forme de l’azotate de cuivre qui est bleu et reste dissous et un gaz rouge appelé hypoazotide (AzO3).
51. Propriétés de l’acide azotique.
I. COULEUR ET CONCENTRATION
L’acide azotique est connu dans le commerce sous le nom d’acide nitrique ; on l’y trouve à divers degrés de concentration. L’acide concentré est jaune foncé, coloration due à de l’hypoazotide qu’il dissout. Il s’unit facilement à l’eau. Abandonné à l’air, il se combine à la vapeur d’eau atmosphérique et les vapeurs de l’acide plus hydraté, ainsi formé, se condensent en un brouillard ; d’où le nom d’acide fumant donné à l’acide azotique concentré. L’acide étendu d’eau est incolore et ne fume pas.
II. POUVOIR OXYDANT
L’acide azotique est un oxydant énergique ; il se décompose facilement en eau, oxygène et composés d’oxygène et d’azote moins oxygénés que lui et parmi lesquels se trouve l’hypoazotide ; cette action est plus ou moins vive suivant que le corps sur lequel il agit est plus ou moins oxydable, et aussi, en général, suivant que l’acide est plus ou moins concentré. La décomposition de l’acide fumant en eau, oxygène et hypoazotide se fait sous la seule influence de la lumière, ce qui explique la couleur de cet acide :
Il y aurait quelque danger à faire agir l’acide azotique sur le phosphore, surtout l’acide concentré, le phosphore étant très oxydable ; l’action est très vive et des morceaux enflammés de phosphore peuvent être projetés. On peut sans danger réaliser l’expérience avec des corps moins oxydables que le phosphore, le charbon et le soufre, par exemple.
1° Oxydation du soufre. — Dans un tube à essai, versons sur une petite quantité de fleur de soufre de l’acide concentré ; chauffons légèrement : nous voyons les vapeurs rouges d’hypoazotide. Le soufre s’est oxydé et est devenu de l’acide sulfurique ; pour mettre cet acide en évidence, versons le contenu du tube dans une dissolution limpide d’un sel de baryum, l’azotate, par exemple ; du sulfate de baryum, insoluble, trouble l’eau et se dépose :
2° Action sur les métaux. — L’acide azotique attaque les métaux, sauf l’or et le platine, et cette propriété lui a fait donner le nom d’eau-forte. Son action sur le cuivre nous a servi à le caractériser ; elle est utilisée dans la gravure dite à l’eau-forte. Sur une plaque de cuivre bien polie, on étend une mince couche de cire ; on exécute le dessin en enlevant la cire avec un stylet, de façon à mettre le métal à nu. On verse l’acide étendu qui attaque le cuivre et non la cire, puis on enlève la cire en lavant la plaque à l’essence de térébenthine.
L’acide azotique sert à nettoyer (décaper) les métaux qu’on veut travailler ; il attaque superficiellement le métal et enlève en même temps l’oxyde qui le ternissait.
III. ACTION SUR LES MATIÈRES ORGANIQUES
L’action de l’acide azotique sur les matières organiques est rarement une oxydation simple ; le plus souvent la réaction est plus compliquée. Il attaque un grand nombre de matières organiques ; il colore la peau en jaune et peut causer des brûlures graves ; on applique l’acide étendu d’eau sur les verrues, qu’il détruit peu à peu. Les vapeurs qu’émet l’acide fumant sont très dangereuses à respirer.
1° Action sur la laine et la soie. — L’acide azotique colore en jaune la laine et la soie blanches. Dans l’industrie, on trempe les étoffes quelques instants dans l’acide, puis on lave à grande eau pour enlever le liquide corrosif qui rongerait le tissu.
2° Action sur le coton. — Un morceau de ouate trempé quelques minutes dans l’acide concentré, puis lavé et desséché, se transforme en un corps de même apparence, mais extrêmement inflammable. C’est le coton-poudre ou fulmi-coton, qui brûle très rapidement en ne donnant que des gaz ; on le comprime en cartouches et on l’emploie dans les mines à la place de la poudre. Dans un trou de la roche, on tasse du coton-poudre qu’on enflamme à distance à l’aide d’une longue mèche. On ne peut employer ce corps dans les armes, parce que le volume de gaz formé brusquement est si grand que les armes seraient brisées.
3° Action sur la glycérine. — Quand l’acide azotique concentré agit sur la glycérine, il la transforme en un liquide, la nitro-glycérine, qui détone par le choc, une élévation de température ou même sans raison apparente. Ce corps est très difficile à manier ; si on lui ajoute de la brique pilée ou du sable, on obtient un corps solide, la dynamite, qui est transportable et détone moins facilement.
52. Préparation de l’acide azotique.
On extrait l’acide azotique de l’azotate de potassium qu’on appelle encore salpêtre ou nitre, d’où le nom d’acide nitrique.

Le salpêtre est une poudre blanche qui se forme sur les murs humides des caves, des écuries, etc. On le met dans une cornue (fig. 51) et on y ajoute de l’acide sulfurique qui donne avec le potassium du sulfate de potassium. Comme il faut chauffer, l’acide azotique se dégage en vapeurs que l’on condense dans un ballon refroidi. On verse l’acide sulfurique par un long tube à entonnoir allant jusqu’au fond de la cornue ; on prend cette précaution parce que, s’il y avait de l’acide sulfurique sur les parois du col, il serait entraîné avec les vapeurs d’acide azotique. On ne peut employer de bouchons : l’acide azotique détruit le liège et le caoutchouc ; on prend, pour condenser les vapeurs d’acide, un ballon à long col dans lequel on fait entrer le col de la cornue.
53. Caractère de l’acide sulfurique.
Nous avons déjà reconnu l’acide sulfurique par son action sur un sel de baryum ; l’eau se trouble, le sulfate de baryum formé étant insoluble dans l’eau.
54. Propriétés de l’acide sulfurique.
L’acide sulfurique, liquide incolore quand il est pur, est souvent brunâtre ; il est visqueux ; on l’extrayait autrefois du sulfate de fer ou vitriol vert, et on l’appelait huile de vitriol.
I. COMBINAISON AVEC L’EAU
La principale propriété de l’acide sulfurique est de se combiner très facilement à l’eau ; si on laisse à l’air un vase contenant de l’acide sulfurique, il augmente de poids, parce que l’acide absorbe la vapeur d’eau atmosphérique.
Versons doucement de l’acide sulfurique dans de l’eau. La température du liquide s’élève beaucoup ; les deux corps ne sont donc pas simplement mélangés, ils sont combinés, et leur combinaison dégage beaucoup de chaleur. Il faut prendre de grandes précautions quand on dilue l’acide sulfurique ; on doit verser lentement l’acide dans l’eau en agitant avec une baguette de verre, de façon à répartir uniformément la chaleur dégagée. Si un verse l’eau dans l’acide, elle se vaporise par suite de l’élévation de température et la vapeur entraîne des gouttes d’acide dont les brûlures sont dangereuses.
On utilise l’acide sulfurique pour dessécher ceux des gaz sur lesquels il n’a pas d’action. Pour augmenter la surface de contact entre le gaz et l’acide, on imbibe d’acide des fragments de pierre ponce placés dans des tubes en U, et que le gaz est forcé de traverser (fig. 52).

Action sur les matières organiques. — L’acide sulfurique se combine si facilement à l’eau qu’il détruit les matières organiques contenant les éléments de l’eau, ainsi le bois, le sucre, la peau, etc. ; le charbon de ces matières se dépose et les noircit ; elles sont carbonisées ; une baguette de bois blanc, un morceau de sucre sur lesquels on verse un peu d’acide sulfurique noircissent rapidement. Les brûlures de l’acide sulfurique sont très graves ; le seul remède est de laver immédiatement à grande eau la partie brûlée.
La couleur brune de l’acide sulfurique provient de ce qu’il renferme des débris de matières organiques carbonisées.
II. ACTION SUR LES MÉTAUX
L’acide sulfurique attaque les métaux, sauf l’or et le platine ; avec le zinc, nous avons obtenu du sulfate de zinc dans la préparation de l’hydrogène ; nous aurions pu employer le fer et nous aurions eu du sulfate de fer.
55. Usages de l’acide sulfurique.
L’acide sulfurique est utilisé dans de nombreuses industries. La France en consomme 80 millions de kilogrammes en une année. Il sert à fabriquer les bougies, les savons, l’acide azotique, l’acide chlorhydrique, l’éther des pharmacies ; il entre dans la constitution des piles électriques.
56. Fabrication de l’acide sulfurique.
La fabrication de l’acide sulfurique s’explique par des réactions complexes. Elle est basée sur l’oxydation du gaz sulfureux par l’acide azotique ; en réalité ce n’est pas l’acide azotique qui agit sur le gaz sulfureux, mais des composés oxygénés de l’azote moins oxygénés que lui et provenant de sa décomposition. Ces composés se reforment ou reforment de l’acide azotique sous l’action de l’eau et de l’oxygène, lequel est fourni par l’air. On voit ainsi qu’un poids donné d’acide azotique peut, si l’on ne tient pas compte des pertes, transformer une quantité illimitée de gaz sulfureux.
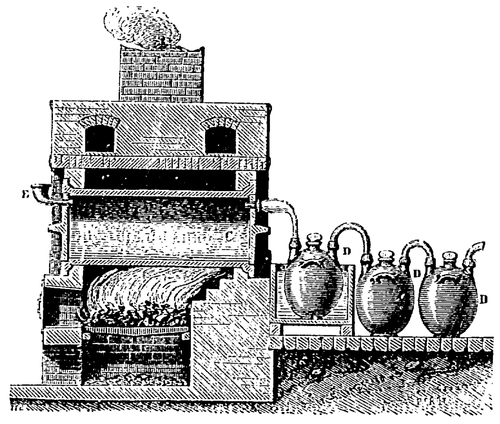
Le gaz sulfureux est fourni par combustion du soufre ou de la pyrite qui est un sulfure de fer naturel (FeS2) ; sa transformation en acide sulfurique s’effectue dans de vastes chambres entièrement doublées de plomb, métal que l’acide étendu n’attaque pas. On concentre ensuite l’acide obtenu en le chauffant d’abord dans de larges bassines de plomb, puis dans des bassines de platine, l’acide sulfurique n’attaquant pas le platine.
57. Caractère de l’acide chlorhydrique.
L’acide chlorhydrique est un gaz caractérisé par son action sur les sels d’argent. Si on le fait arriver dans de l’eau contenant en dissolution un sel d’argent, de l’azotate par exemple, on voit se déposer des grumeaux d’un corps blanc, le chlorure d’argent, qui noircit à la lumière :
58. Propriétés de l’acide chlorhydrique.
I. SOLUBILITÉ DANS L’EAU

L’acide chlorhydrique est très soluble dans l’eau ; l’eau en dissout environ cinq cents fois son volume. Cette dissolution constitue l’acide chlorhydrique du commerce ; incolore quand elle est pure, elle est souvent jaune. Le gaz qui s’en dégage a une odeur piquante ; il absorbe l’humidité et fume à l’air.
On peut montrer la grande solubilité de l’acide chlorhydrique dans l’eau par les expériences suivantes :

1° Remplissons une éprouvette de gaz sur la cuve à mercure (fig. 53) ; transportons-la, en la fermant par une soucoupe contenant un peu de mercure, dans une cuve à eau, et soulevons légèrement l’éprouvette ; l’eau dissout très vite le gaz et monte brusquement dans l’éprouvette. Si l’acide chlorhydrique est très pur, la dissolution peut se faire assez vite pour que l’eau, frappant les parois et le fond de l’éprouvette, la brise. On préserve la main des éclats de verre en l’enveloppant d’un linge.
2° Remplissons un flacon de gaz chlorhydrique ; fermons-le avec un bouchon traversé par un tube ; l’extrémité du tube qui pénètre dans le flacon est effilée, l’autre porte un robinet (fig. 54), ou bien elle a été fermée à la lampe. Retournons le flacon au-dessus d’un vase contenant de l’eau bleuie par de la teinture de tournesol, et de manière que le tube plonge dans l’eau. Ouvrons le robinet, ou cassons la pointe ; le liquide monte à mesure qu’il dissout le gaz, et l’eau qui jaillit est rose ; si le flacon contient de l’acide chlorhydrique pur, l’eau le remplit complètement.
II. ACTION SUR LES MÉTAUX
L’acide chlorhydrique attaque les métaux, sauf l’or et le platine. On pourrait préparer l’hydrogène en substituant cet acide à l’acide sulfurique ; on obtiendrait du chlorure de zinc ou du chlorure de fer suivant le métal employé.
L’or et le platine, qui ne sont attaqués ni par l’acide chlorhydrique ni par l’acide azotique, peuvent être dissous par un mélange de ces deux acides, appelé eau régale parce qu’il dissout l’or, le roi des métaux. Versons dans un verre de l’acide chlorhydrique, dans un autre de l’acide azotique, et mettons dans chacun d’eux une feuille d’or : le métal ne disparaît pas ; mais versons le contenu d’un verre dans l’autre, l’or se dissout.
59. Préparation de l’acide chlorhydrique.
Nous avons vu, à propos de la préparation du chlore, que le chlorure de sodium sert à préparer l’acide chlorhydrique ; pour cela, on lui ajoute de l’acide sulfurique, qui forme du sulfate de sodium :
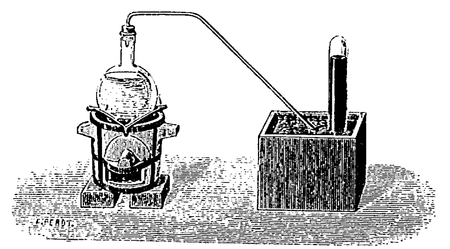
On chauffe les corps dans un ballon, on recueille le gaz soit sur la cuve à mercure, soit par déplacement d’air, car il est plus léger que l’air (fig. 55), Si on veut en avoir une dissolution, il suffit de faire arriver le tube de dégagement dans un flacon rempli d’eau. Dans l’industrie, on prépare l’acide chlorhydrique dans des vases de fer (fig. 56) ; il forme aux dépens du métal une petite quantité de chlorure de fer qui jaunit la dissolution.