Cette page a été validée par deux contributeurs.
73
la chimie physique et la géologie (suite)
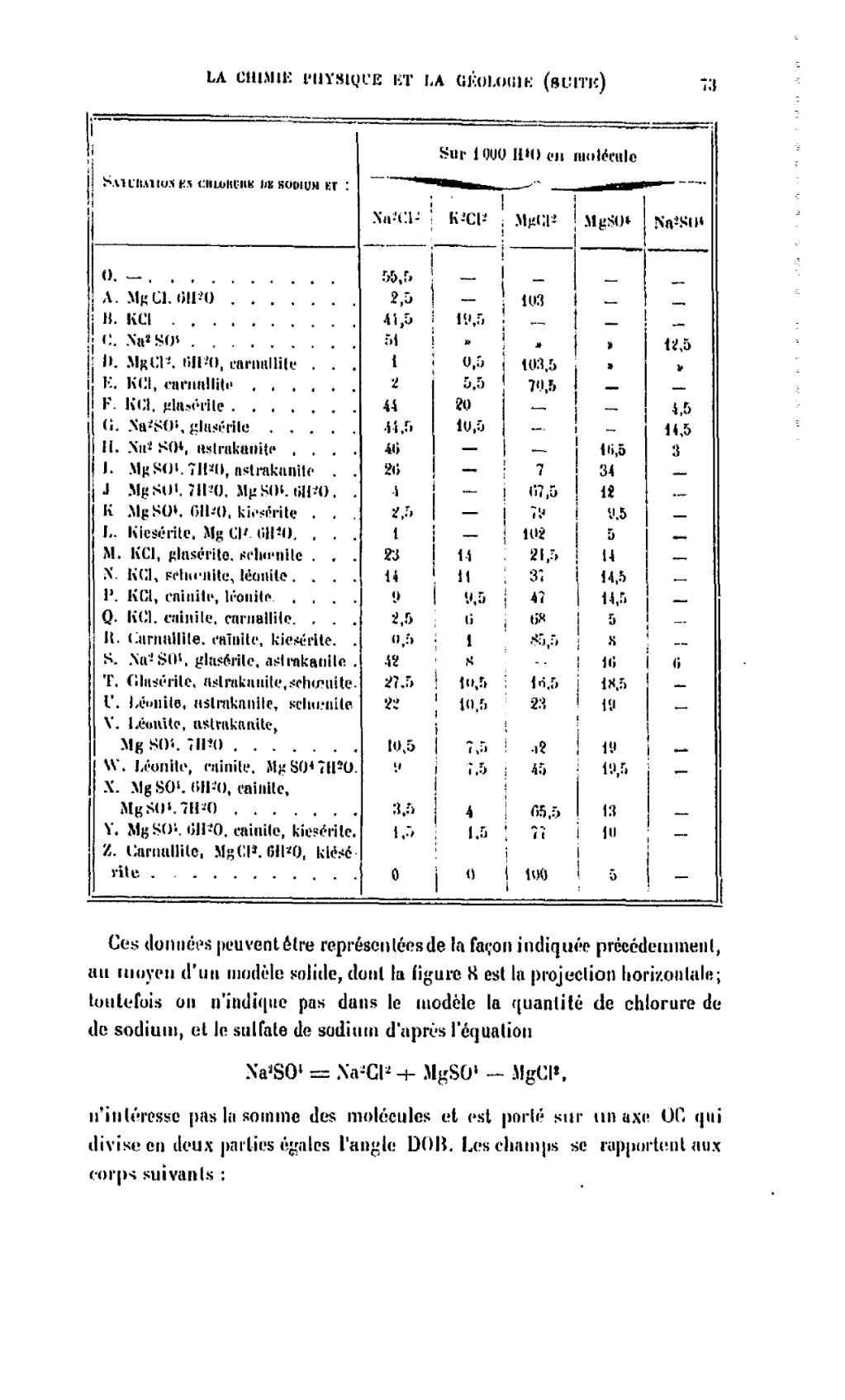
| Saturation en chlorure de sodium et : | Sur 1 000 H2O en molécules | |||||
| Na2Cl2 | K2Cl2 | MgCl2 | MgSO4 | Na2SO4 | ||
| O. | — | 55,5 | — | — | — | — |
| A. | MgCl2. 6 H2O | 2,5 | — | 103 | — | — |
| B. | KCl | 41,5 | 19,5 | — | — | — |
| C. | Na2SO4 | 51 | — | — | — | 12,5 |
| D. | MgCl2. 6 H2O, carnallite | 1 | 0,5 | 103,5 | — | — |
| E. | KCl, carnallite | 2 | 5,5 | 70,5 | — | — |
| F. | KCl, glasérite | 44 | 20 | — | — | 4,5 |
| G. | Na2SO4, glasérite | 44,5 | 10,5 | — | — | 14,5 |
| H. | Na2SO4, astrakanite | 46 | — | — | 16,5 | 3 |
| I. | MgSO4. 7 H2O, astrakanite | 26 | — | 7 | 34 | — |
| J. | MgSO4. 7 H2O, MgSO4. 6 H2O | 4 | — | 67,5 | 12 | — |
| K. | MgSO4. 6 H2O, kiesérite | 2,5 | — | 79 | 9,5 | — |
| L. | Kiesérite, MgCl2. 6 H2O | 1 | — | 102 | 5 | — |
| M. | KCl, glasérite, schœnite | 23 | 14 | 21,5 | 14 | — |
| N. | KCl, schœnite, léonite | 14 | 11 | 37 | 14,5 | — |
| P. | KCl, cainite, léonite | 9 | 9,5 | 47 | 14,5 | — |
| Q. | KCl, cainite, carnallite | 2,5 | 6 | 68 | 5 | |
| R. | Carnallite, cainite, kiesérite | 0,5 | 1 | 85,5 | 8 | — |
| S. | Na2SO4, glasérite, astrakanite | 42 | 8 | — | 16 | 6 |
| T. | Glasérite, astrakanite, schœnite | 27,5 | 10,5 | 16,5 | 18,5 | — |
| U. | Léonite, astrakanite, schœnite | 22 | 10,5 | 23 | 19 | — |
| V. | Léonite, astrakanite, MgSO4. 7 H2O | 10,5 | 7,5 | 42 | 19 | — |
| W. | Léonite, cainite, MgSO4. 7 H2O | 9 | 7,5 | 45 | 19,5 | — |
| X. | MgSO4. 6 H2O, cainite, MgSO4. 7 H2O | 3,5 | 4 | 65,5 | 13 | — |
| Y. | MgSO4. 6 H2O, cainite, kiesérite | 1,5 | 1,5 | 77 | 10 | — |
| Z. | Carnallite, MgSO4. 6 H2O, kiesérite | 0 | 0 | 100 | 5 | — |
Ces données peuvent être représentées de la façon indiquée précédemment, au moyen d’un modèle solide, dont la figure 8 est la projection horizontale ; toutefois on n’indique pas dans le modèle la quantité de chlorure de sodium, et le sulfate de sodium d’après l’équation
Na2SO4 = Na2Cl2 + MgSO4 − MgCl2,
n’intéresse pas la somme des molécules et est porté sur un axe OC qui divise en deux parties égales l’angle DOB. Les champs se rapportant aux corps suivants :