Leçons élémentaires de chimie/2
CHAPITRE II
HYDROGÈNE
7. Caractère de l’hydrogène.
Nous avons vu qu’on reconnaît l’hydrogène à ce qu’il éteint une allumette enflammée, et brûle avec une flamme à peine visible.
8. Propriétés de l’hydrogène.
I. LÉGÈRETÉ
Ce gaz est très léger. Il pèse environ 14,5 fois moins que l’air et un litre d’air pèse 1gr,3. On peut mettre sa légèreté en évidence par les expériences suivantes :

1° Inclinons au-dessous d’une éprouvette pleine d’air (fig. 10), tenue verticalement, une éprouvette de même grandeur, remplie d’hydrogène, et renversons progressivement celle-ci. L’hydrogène s’élève dans l’éprouvette supérieure dont il chasse l’air ; on s’en assure en enflammant le gaz au bout de quelques instants.

2° On gonfle avec de l’hydrogène des bulles de savon ; elles s’élèvent dans l’air et on peut les enflammer pendant leur ascension (fig. 11). Les petits ballons d’enfants et les aérostats sont gonflés avec de l’hydrogène pur, ou avec du gaz d’éclairage, qui est un mélange d’hydrogène et d’autres gaz.
II. DIFFUSIBILITÉ
L’hydrogène traverse facilement les membranes ; cette propriété qui est la diffusibilité appartient à tous les gaz, mais inégalement ; ils se diffusent d’autant mieux qu’ils sont plus légers. Si on couvre d’une feuille de papier l’extrémité d’un tube par lequel se dégage de l’hydrogène, le gaz traverse la feuille de papier au-dessus de laquelle on peut l’allumer. Les ballons se dégonflent toujours, bien qu’on cherche à fabriquer des enveloppes aussi imperméables que possible. Un ballon gonflé de gaz d’éclairage se dégonfle moins vite qu’un ballon gonflé d’hydrogène, le gaz d’éclairage étant beaucoup plus lourd que l’hydrogène, mais aussi il s’élève moins bien.
III. COMBUSTION
L’hydrogène en brûlant se combine à l’oxygène de l’air, c’est la combustion de l’hydrogène (fig. 12). Le produit de cette combinaison est de la vapeur d’eau ; on le constate en enflammant au bout d’un tube effilé de l’hydrogène soigneusement desséché ; si on entoure la flamme avec une cloché froide, celle-ci se couvre de buée.

De même qu’en décomposant l’eau, on en a séparé les éléments hydrogène et oxygène (ce qui s’appelle faire une analyse), on peut avec les deux gaz refaire de l’eau (synthèse). Retournons sur la cuve à eau un flacon plein d’eau ; faisons-y passer un tiers de son volume d’oxygène et deux tiers d’hydrogène. Entourons le flacon d’un linge mouillé pour préserver la main en cas de rupture, et approchons-le d’une flamme. Une forte détonation se fait entendre. Les deux gaz se combinent et produisent de la vapeur d’eau avec grand dégagement de chaleur. La vapeur d’eau se condense ensuite, d’où un vide dans le flacon, et l’air, rentrant brusquement, produit sur les parois un choc, cause de la détonation. Un fait analogue se produit, mais avec beaucoup moins de violence, quand on enflamme l’hydrogène contenu dans une éprouvette.

La flamme de l’hydrogène est très chaude : elle rougit un fil d’acier. Elle est pâle. Pour la rendre éclairante, on verse un peu de benzine dans l’appareil producteur du gaz. La benzine est formée de charbon et d’hydrogène ; elle est décomposée, et les parcelles solides de charbon, portées au rouge, donnent à la flamme son éclat. — Ceci est général : une flamme est pâle quand elle n’est formée que de corps gazeux incandescents ; elle devient éclairante si on y introduit des particules solides.
On utilise généralement la flamme de l’hydrogène au moyen du chalumeau. Cet appareil (fig. 13) se compose de deux tubes emboîtés l’un dans l’autre ; par le tube intérieur, on fait arriver de l’oxygène, et dans l’espace annulaire de l’hydrogène ; on enflamme le gaz à l’extrémité du tube. Remarquons qu’il n’y a pas mélange détonant, puisque l’oxygène n’arrive sur l’hydrogène qu’au fur et à mesure de la combustion. Cette flamme très chaude sert à travailler le verre dans les laboratoires ; on remplacé alors l’hydrogène par le gaz d’éclairage et l’oxygène par l’air qu’on envoie à l’aide d’une soufflerie. On fond, à l’aide du chalumeau, certains corps difficilement fusibles comme le platine (il fond à 1800°). On dirige l’extrémité amincie de la flamme ou dard du chalumeau sur le métal placé dans un creuset de chaux, infusible à cette température (fig. 14).

En introduisant dans la flamme du chalumeau un bâton de chaux, on obtient une vive lumière utilisée dans les appareils à projection ; c’est la lumière Drummond, ou lumière oxhydrique (fig. 15).
9. Préparation de l’hydrogène.
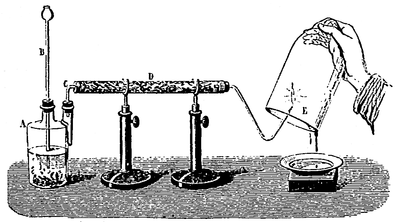
On retire l’hydrogène de l’eau. On pourrait le recueillir dans le voltamètre, mais cette préparation serait longue et coûteuse. On décompose, par le zinc, l’eau acidulée d’acide sulfurique. On prend (fig. 16) un flacon à deux tubulures dans lequel on met de l’eau et du zinc en petits morceaux, pour présenter une grande surface à l’action de l’acide. Par l’une des tubulures passe un tube à entonnoir plongeant dans l’eau et qui sert à verser l’acide ; par l’autre, un tube abducteur qui conduit le gaz dans une éprouvette placée sur la cuve à eau. Une effervescence se produit, et le zinc se dissout peu à peu dans le liquide.

On peut de plus constater au toucher que le flacon est très chaud. Si, l’expérience terminée, on fait évaporer l’eau restant dans le flacon, il se dépose un corps blanc, cristallisé, le sulfate de zinc*.

Si on veut enflammer l’hydrogène, on remplace le tube abducteur par un tube effilé (fig. 17). Mais on aura grand soin : 1° de s’assurer que l’appareil ne présente par les tubulures aucune communication avec l’air extérieur, ce que l’on reconnaît en fermant le tube abducteur avec le doigt pendant quelques secondes ; l’hydrogène s’accumule dans le flacon et sa pression fait monter le liquide dans le tube à entonnoir ; 2° d’attendre, avant d’allumer le gaz, que l’appareil fonctionne depuis un temps assez long pour éviter la détonation que produirait le mélange de l’hydrogène et de l’air du flacon.
10. Mélange et combinaison.
Cette leçon nous permet de déduire des faits observés quelques considérations générales. Revenons à la synthèse de l’eau. Avant d’approcher le flacon de la flamme, l’hydrogène et l’oxygène sont mélangés ; après, ils sont combinés.
La différence entre le mélange et la combinaison est très importante :
1° Le corps résultant d’une combinaison a des propriétés différentes de celles des corps qui le composent. Ainsi l’eau n’a ni les propriétés de l’oxygène, ni celles de l’hydrogène.
2° La combinaison est accompagnée le plus souvent d’un dégagement de chaleur. Le flacon producteur d’hydrogène s’échauffe beaucoup par suite des combinaisons qui s’y produisent. Quand nous enflammons de l’hydrogène, nous amenons le gaz qui est au contact de la flamme à la température à laquelle il peut se combiner à l’oxygène, puis, par suite de la combinaison même, le dégagement de chaleur est suffisant pour permettre la combustion de tout le gaz.
3° La décomposition de 9 grammes d’eau donne toujours 8 grammes d’oxygène et 1 gramme d’hydrogène ; il n’y a donc ni perte ni gain de matière (loi de Lavoisier).
4° Les poids des corps qui se combinent sont dans un rapport déterminé (loi de Proust). Ainsi, pour faire de l’eau, il faut un poids d’hydrogène 8 fois plus petit que le poids d’oxygène employé : 2 grammes d’hydrogène et 16 grammes d’oxygène donnent 18 grammes d’eau ; 3 grammes d’hydrogène et 16 grammes d’oxygène donnent encore 18 grammes d’eau ; et il reste 1 gramme d’hydrogène non employé. Un mélange peut, au contraire, être fait en toutes proportions.