La Chimie physique et ses applications/8
HUITIÈME LEÇON
Maintenant que nous avons appris à appliquer le principe de la cristallisation, il nous sera facile de faire rentrer dans notre étude les autres combinaisons qui prennent part à la formation des sels naturels ; ce sont le chlorure de sodium et les sels de calcium.
Je n’ai pas l’intention d’entrer dans les détails, je tiens seulement à vous faire observer qu’on peut établir et qu’on a, en effet, établi un schéma analogue à celui de la figure 7 pour le cas où, à la température de 25°, toutes les solutions sont saturées de chlorure de sodium, ce qui correspond toujours aux relations naturelles. Quant aux sels de calcium, leur faible solubilité fait qu’ils ne changent que peu la composition de ces solutions, et il nous faut seulement établir de quelles solutions le calcium se déposera à l’état de gypse CaSO4. 2 H2O, d’anhydrite CaSO4, de syngénite CaSO4. K2SO4. H2O, ou sous toute autre forme.
Ce que je voudrais mettre en évidence dans cette seconde leçon consacrée à la géologie, c’est le rôle du temps, de la température et de la pression, qui est de grande importance.
Le temps joue un rôle capital, et c’est précisément son influence qu’il est le plus difficile d’étudier par des expériences de laboratoire. Dans les expériences de cristallisation directe de l’eau de mer, telles que les a exécutées Usiglio, il est évident que c’est du temps qu’on a tenu le moindre compte et c’est pourquoi il est à peu près impossible de se rapprocher de cette façon des phénomènes géologiques. La manière d’opérer que nous avons introduite nous permet d’obtenir davantage. Au début elle nous a donné des résultats qui ne différaient pas essentiellement de ceux d’Usiglio ; toutefois, à la longue, apparaissent l’un après l’autre des composés dont la formation dans la méthode ordinaire de cristallisation peut être retardée d’une façon tout à fait inattendue. De tels retards vous sont bien connus dans les solutions dites sursaturées, comme celles du sulfate de sodium. La sursaturation est facile à écarter par l’addition du corps par rapport auquel la solution est sursaturée, ici le sulfate de sodium, c’est pourquoi nous avons toujours préparé nos solutions saturées par une agitation prolongée avec les sels qu’on voulait dissoudre, et en outre, pour bien déterminer le sens de la saturation, un essai filtré était mis en contact avec des cristaux bien formés des même sels. De cette façon, ce n’était qu’une question d’heures, au plus de jours, mais il s’est trouvé que certains composés, qui à 25° devaient se former dans les solutions étudiées n’apparaissaient pas du tout. Ce sont, abstraction faite des sels de calcium, la léonite (SO4)2MgK2. 4 H2O, la cainite SO4Mg. KCl. 3 H2O, et la kiesérite SO4Mg. H2O. Même après une cristallisation très lente après addition de ces composés comme tels ne fait pas cesser la sursaturation par rapport à ces corps.
Ici précisément se montre la supériorité de la nouvelle méthode, puisque les indications ne sont pas fournies par des expériences directes de cristallisation, et que par l’établissement d’un nombre relativement restreint de données relatives à la solubilité on peut étudier qualitativement et quantitativement l’ensemble des phénomènes de la cristallisation. Ces données s’obtiennent facilement malgré le retard dont je viens de parler, les expériences de saturation par agitation n’exigeant qu’un temps modéré. Voici d’abord les données ainsi obtenues :
| Saturation en chlorure de sodium et : | Sur 1 000 H2O en molécules | |||||
| Na2Cl2 | K2Cl2 | MgCl2 | MgSO4 | Na2SO4 | ||
| O. | — | 55,5 | — | — | — | — |
| A. | MgCl2. 6 H2O | 2,5 | — | 103 | — | — |
| B. | KCl | 41,5 | 19,5 | — | — | — |
| C. | Na2SO4 | 51 | — | — | — | 12,5 |
| D. | MgCl2. 6 H2O, carnallite | 1 | 0,5 | 103,5 | — | — |
| E. | KCl, carnallite | 2 | 5,5 | 70,5 | — | — |
| F. | KCl, glasérite | 44 | 20 | — | — | 4,5 |
| G. | Na2SO4, glasérite | 44,5 | 10,5 | — | — | 14,5 |
| H. | Na2SO4, astrakanite | 46 | — | — | 16,5 | 3 |
| I. | MgSO4. 7 H2O, astrakanite | 26 | — | 7 | 34 | — |
| J. | MgSO4. 7 H2O, MgSO4. 6 H2O | 4 | — | 67,5 | 12 | — |
| K. | MgSO4. 6 H2O, kiesérite | 2,5 | — | 79 | 9,5 | — |
| L. | Kiesérite, MgCl2. 6 H2O | 1 | — | 102 | 5 | — |
| M. | KCl, glasérite, schœnite | 23 | 14 | 21,5 | 14 | — |
| N. | KCl, schœnite, léonite | 14 | 11 | 37 | 14,5 | — |
| P. | KCl, cainite, léonite | 9 | 9,5 | 47 | 14,5 | — |
| Q. | KCl, cainite, carnallite | 2,5 | 6 | 68 | 5 | |
| R. | Carnallite, cainite, kiesérite | 0,5 | 1 | 85,5 | 8 | — |
| S. | Na2SO4, glasérite, astrakanite | 42 | 8 | — | 16 | 6 |
| T. | Glasérite, astrakanite, schœnite | 27,5 | 10,5 | 16,5 | 18,5 | — |
| U. | Léonite, astrakanite, schœnite | 22 | 10,5 | 23 | 19 | — |
| V. | Léonite, astrakanite, MgSO4. 7 H2O | 10,5 | 7,5 | 42 | 19 | — |
| W. | Léonite, cainite, MgSO4. 7 H2O | 9 | 7,5 | 45 | 19,5 | — |
| X. | MgSO4. 6 H2O, cainite, MgSO4. 7 H2O | 3,5 | 4 | 65,5 | 13 | — |
| Y. | MgSO4. 6 H2O, cainite, kiesérite | 1,5 | 1,5 | 77 | 10 | — |
| Z. | Carnallite, MgSO4. 6 H2O, kiesérite | 0 | 0 | 100 | 5 | — |
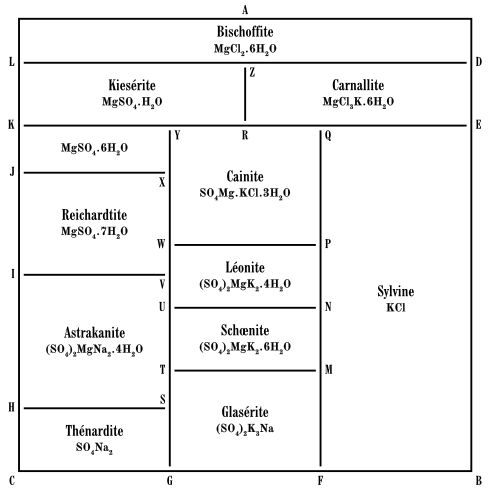
Ces données peuvent être représentées de la façon indiquée précédemment, au moyen d’un modèle solide, dont la figure 8 est la projection horizontale ; toutefois on n’indique pas dans le modèle la quantité de chlorure de sodium, et le sulfate de sodium d’après l’équation
n’intéresse pas la somme des molécules et est porté sur un axe OC qui divise en deux parties égales l’angle DOB. Les champs se rapportant aux corps suivants :

Fig. 8
| Champ | Formule | Dénomination minéralogique |
| 1. ALZD | MgCl2.6H2O | Bischoffite. |
| 2. BFMNPQE | KCl | Sylvine. |
| 3. CGSH | Na2SO4 | Thénardite. |
| 4. DZRQE | MgCl3K.6H2O | Carnallite. |
| 5. FMTSG | K3Na(SO4)2 | Glasérite. |
| 6. SHIVUT | Na2Mg(SO4)2.4H2O | Astrakanite. |
| 7. JXWVI | MgSO4.7H2O | Reichardite. |
| 8. JXYK | MgSO4.6H2O | N’a pas été trouvé. |
| 9. KYRZL | MgSO4.H2O | Kiesérite. |
| 10. TUNM | K2Mg(SO4)2.6H2O | Schœnite. |
| 11. NUVWP | K2Mg(SO4)2.4H2O | Léonite. |
| 12. PWXYRQ | SO4Mg.KCl.3H2O | Cainite. |
En seconde ligne vient l’effet de la température. La température, comme on sait, exerce en général une influence sur la solubilité, et le diagramme relatif à 25° doit être modifié si la température est différente. Il est essentiel pour notre but de chercher quels enseignements nous pouvons en tirer pour la géologie. Ce qui est surtout caractéristique, c’est l’apparition d’espèces minérales qui ne se forment pas encore à la température de 25°, puis la production de certains mélanges de minéraux et enfin la disparition de minéraux qui ne peuvent exister au delà d’une température déterminée.
De corps qui n’apparaissent qu’au-dessus de 25°, je citerai deux exemples. Parmi les chlorures et sulfates de potassium, de sodium et de magnésium, il n’est que deux minéraux connus qu’on n’obtient pas à 25°, la langbeinite et la lœwite. Ce n’est pas à cause d’un retard de la cristallisation, que ces composés n’apparaissent pas, car placés dans des solutions à 25° où ils devraient être les premiers à se former, ils se décomposent en absorbant de l’eau ; la langbeinite fournit un mélange de sulfate de magnésium et de léonite, selon l’équation :
et la lœwite donne de l’astrakanite
Ceci va nous renseigner pour la détermination de la température à laquelle ces corps se forment il suffit de chauffer leurs produits d’hydratation avec la solution qui en est saturée et agit sur l’eau avec la plus grande force attractive. Pour la langbeinite, la solution W de la figure 8 présente la saturation voulue en sulfate de magnésium et en léonite, et en outre la caïnite, par rapport à laquelle il y a aussi saturation, ajoute son action attractive pour l’eau. Dans cette solution, au-dessus de 37°, la langbeinite se reforme de ses produits d’hydratation et se détruit de nouveau à une température plus basse. La présence de la langbeinite dans les dépôts salins indique donc pour ceux-ci une température de formation supérieure à 37°. Une limite analogue pour la lœwite a été trouvée égale à 43°.
Considérons maintenant une seconde influence de la température, celle qu’elle exerce sur la formation des mélanges de minéraux. La figure 8 l’exprime pour 25° ; nous allons toutefois la simplifier (fig. 9) en conservant les lignes limites mais en changeant la forme des champs de façon à en faire des rectangles. Alors on voit, par exemple, que la glasérite peut apparaître avec l’astrakanite, mais non avec la bischoffite, et ainsi la figure 9 résume un certain nombre de conclusions géologiques.
Lorsque, dans une leçon faite à Stassfurt sur ce sujet, j’ai présenté cette figure 9, M. Schwab a appelé mon attention sur le sel dur (Hartsatz), mélange de kiesérite et de chlorure de potassium, qui ne peut se former à 25°, puisque le champ de la caïnite sépare les champs de ces deux minéraux ; ce problème a été étudié pur Meyerhoffer, qui a trouvé que le sel dur est le produit d’une température beaucoup plus élevée, environ 70°, la plus haute dont on ait obtenu une indication certaine dans ce domaine.
Un troisième fait, la disparition de certaines espèces minérales, pourrait également être utilisé pour la thermométrie géologique. Par exemple la reichardite MgSO4. 7 H2O est limitée dans son existence par la température de 47°, la schœnite, par celle de 47°,5.
Il nous reste enfin à parler de la pression, qui est souvent tout indiquée comme un agent de production de minéraux qui, par suite du retard à la cristallisation, ne se forment pas dans les expériences ordinaires de laboratoire, par exemple l’anhydrite. À un examen plus précis, il semble toutefois que le rôle de la pression dans la formation des dépôts salins naturels soit relativement peu important. À Stassfurt, par exemple, on peut compter sur une profondeur de mer maximum de 1 500 mètres, ce qui pour un poids spécifique 1,2 au commencement de la séparation du sel, correspond à une pression de
Par la pression, et c’est ce qu’il est essentiel de remarquer, la température de formation, comme celle de 37° indiquée plus haut pour la langbeinite, se trouve déplacée ; elle est relevée par une augmentation de pression lorsque, comme c’est le cas général, ces formations qui ont lieu avec perte d’eau s’accompagnent d’un accroissement du volume total.
Ces déplacements sont du même ordre de grandeur que les variations des points de fusion par la pression. Ceci peut s’établir théoriquement, et nous avons effectué des déterminations expérimentales sur la formation de la tachydrite Mg2CaCl6. 12 H2O qui nous ont donné ce résultat prévu que la température de formation, ici 22°, ne s’élève que de quelques millièmes de degré, exactement 0°,017, pour une atmosphère, ce qui pour 180 atmosphères correspond à environ 3°.
Comme il faut, dans la formation naturelle des dépôts salins, compter avec les variations de la température, qui, d’après les observations de Kaleczinsky sur les lacs salés de Transylvanie[1], peuvent atteindre jusqu’à 50°, on voit que dans la question qui nous occupe l’influence de la pression est bien moindre que celle de la température.
- ↑ Ueber die ungarischen warmen und heissen Kochsalzseen. Budapest, 1901.