La Chimie physique et ses applications/7
SEPTIÈME LEÇON
Je consacrerai les deux dernières leçons que j’ai à vous faire aux rapports de la chimie physique et de la géologie, et je vous résumerai les études qui m’ont particulièrement occupé pendant ces dernières années et pour lesquelles j’ai profité de la collaboration de M. Meyorhoffer.
On peut dire que, dans la formation de la croûte terrestre, deux phénomènes qui sont du ressort de la chimie physique ont joué un rôle capital :
1o Le refroidissement lent de la masse fluide et la solidification progressive de celle-ci ;
2o La concentration des solutions liquides avec formation de dépôts solides.
Dans les deux cas on a des déplacements de l’état d’équilibre, les uns sont plutôt de nature physique, comme la solidification et la cristallisation ; mais il y a aussi des déplacements de l’équilibre chimique qui sont dus à la variation de la température et de la concentration.
Pour entrer dans notre sujet, je remarquerai tout d’abord que les grands phénomènes de concentration qui ont de l’importance en géologie se sont produits dans l’eau de mer ou dans une solution de composition analogue. C’est là que se sont formés les puissants dépôts salins qui sont aujourd’hui la matière première de la production industrielle des sels. S’il ne s’agissait que du sel gemme ou chlorure de sodium, c’est-à-dire si l’eau de mer ne contenait pas d’autres corps accessoires ou secondaires, la question de la concentration aurait à peine besoin d’éclaircissement : l’eau s’évapore et le sel cristallise. Mais il est de la plus haute importance, aussi bien au point de vue technique qu’au point de vue minéralogique et géologique, de considérer que les substances accessoires de l’eau de mer, le magnésium, le potassium et le calcium à l’état de chlorures et de sulfates, l’acide borique, l’acide carbonique, le brome, le fer, etc., ont joué un rôle qui n’est pas nul, se sont d’abord accumulés dans l’eau, puis ont formé, comme on le voit à Stassfurt, une couche minérale au-dessus du sel gemme déposé antérieurement. Autrefois ces matières étaient rejetées comme étant sans valeur ; on les désignait sous le nom de « sels de déblais » (Abraumsalze) ; elles ont acquis depuis une importance industrielle qui dépasse de beaucoup celle du chlorure de sodium situé au-dessous, et la présence d’une trentaine de minéraux qu’on y rencontre plus ou moins mélangés ou superposés présente un problème dont on n’a pu aborder la solution que dans ces derniers temps, car ce n’est que depuis peu qu’on possède des données suffisantes pour embrasser l’ensemble de la cristallisation des solutions complexes.
Pour vous donner une vue approximative de l’état des choses, je vous dirai que les dépôts disposés par couches superposées peuvent se diviser en quatre régions, dont les deux premières, en partant du bas, sont appelées, du nom de sels de calcium qu’on y rencontre, régions de l’anhydrite (CaSO4) et de la polyhalite (2 CaSO4. MgSO4. K2SO4. 2 H2O). Dans les deux, le sel gemme alterne régulièrement avec de minces bandes formées d’anhydrite dans les couches inférieures et de polyhalite dans les couches plus élevées, dites bandes annuelles, car leur formation résulte de l’alternance des saisons. Les deux régions supérieures sont celles de la kiesérite (SO4Mg. H2O) et de la carnallite (MgCl2. KCl. 6 H2O). Le sel gemme accompagne toujours ces minéraux, mais en proportion décroissante à mesure qu’on s’élève. Cette disposition assez régulière est considérée comme le résultat de la concentration d’une solution analogue à l’eau de mer ; elle est dite primaire ; sont dits secondaires les produits qui en proviennent par une transformation ultérieure, comme la sylvine (KCl) provenant de la carnallite, la cainite (SO4Mg. KCl. 3 H2O) formée de la carnallite et de la kiesérite.
Cette manière de voir a été pour la première fois soumise au contrôle de l’expérience par le chimiste italien Usiglio[1], qui a effectué la concentration de l’eau de mer sur une grande échelle et obtenu comme produits de séparation le carbonate de calcium, le chlorure de sodium, le gypse (SO4Ca. 2 H2O), le sulfate de magnésium avec 6 et 7 molécules d’eau, le chlorure de potassium, la schoenite (SO4Mg. SO4K2. 6 H2O), la carnallite et le chlorure de magnésium mais il lui manqua certains minéraux importants, dont l’anhydrite, la polyhalite et la kiesérite, qui ont donné leur nom à trois des quatre régions des dépôts de Stassfurt ; on va comprendre pourquoi les résultats d’expériences comme celles d’Usiglio ne présentent qu’une concordance imparfaite avec ce qu’on a trouvé dans la nature. Le problème a dû être envisagé d’une façon différente et plus générale ; la question est celle-ci : Quelle est l’influence, non seulement de la composition de la solution, mais encore de la température, de la pression et du temps, sur la nature des dépôts formés ? C’est seulement aujourd’hui que nous sommes à même de répondre.
En premier lieu, j’appellerai votre attention sur un principe qu’on a souvent invoqué et qui, à première vue, paraît évident : la série des produits qui se déposent dans une solution correspond à celle des solubilités, de telle sorte que les corps les plus solubles n’apparaissent que les derniers. Ce principe manque de rigueur. Sans doute il est vérifié d’une façon approximative par la série des régions naturelles de Stassfurt : un sel de calcium peu soluble s’est d’abord séparé à l’état d’anhydrite, puis une combinaison de ce sel avec des sulfates plus solubles a donné la polyhalite ; après cela, le sulfate de magnésium, facilement soluble, s’est déposé seul à l’état de kiésérite et enfin s’est formée la carnallite très soluble. Mais il est évident qu’on pourrait, par exemple, faire une solution assez riche en sulfate de magnésium et assez pauvre en sulfate de calcium pour que, par la concentration, ce soit d’abord le premier de ces sels, le plus soluble qui cristallise. Ainsi la composition de la solution joue un rôle important dans la succession des dépôts qui prennent naissance ; quant à la solubilité, dont le rôle est certainement prépondérant, il faut encore considérer qu’elle varie beaucoup sous l’influence des autres matières contenues dans la dissolution.
Examinons d’abord ces deux facteurs, la composition de la dissolution et la solubilité des substances dissoutes, mais limitons l’influence de la température, de la pression et du temps, en opérant à la température de 25°, à la pression atmosphérique et de la façon ordinaire des laboratoires. Nous suivrons la méthode d’Usiglio dans ses grandes lignes, mais nous généraliserons le problème de la concentration. La concentration de l’eau de mer deviendra un cas particulier, si dans notre recherche générale nous considérons en première ligne les matériaux qui entrent dans sa composition.
Parmi ces matériaux c’est, comme on sait, le chlorure de sodium qui par sa quantité joue le rôle capital ; ensuite viennent les chlorures et les sulfates de magnésium et de potassium, puis les sels de calcium ; nous nous en tiendrons à ces substances. Pour vous donner une idée nette de la composition de l’eau de mer, je vous indiquerai la proportion des composants, qui, ne tenant pas compte des sels de calcium, est remarquablement constante en tous les points du globe et correspond à l’expression suivante en molécules
Développons maintenant pas à pas les lois de la cristallisation en augmentant peu à peu le nombre des corps dissous :
S’il n’y a qu’un sel unique, la chose est assez simple ; par la concentration,
la saturation arrive et le sel se dépose, jusqu’à ce que tout soit desséché.
Mais lorsqu’il y en a deux, quel est celui qui se sépare le premier et
quand apparaît le second ? Nous allons répondre à cette question pour le
mélange de chlorure de sodium et de chlorure de potassium (à 25°C). Si
la solution contient, par exemple, assez de chlorure de potassium pour que
ce sel commence à se déposer, 
Fig. 5 par concentration la proportion de chlorure
de sodium va augmenter jusqu’à ce que ce
sel se dépose aussi ; à partir de ce moment,
la solution conserve sa composition ; elle
ne fait que diminuer en quantité et les
deux sels cristallisent simultanément, jusqu’à
ce que tout le liquide ait disparu. Il
est évident qu’on arrive à la même solution
finale en partant de l’extrémité opposée,
c’est-à-dire d’une solution contenant un
excès suffisant de chlorure de sodium. Ainsi
l’état du système sera donné si l’on connaît
la solution finale saturée des deux sels ;
l’analyse indique pour une solution qui a été agitée assez longtemps à 25°
avec un excès des deux sels, la composition :
de sorte que des solutions dans lesquelles la proportion du chlorure de sodium au chlorure de potassium est supérieure à 89. 58,5 : 39. 74,5 commencent par déposer du chlorure de sodium dans le cas contraire, c’est le chlorure de potassium qui se sépare le premier.
Ici les relations sont encore simples et, afin de conserver la même clarté lorsque nous passerons à des cas plus compliqués, nous allons les exprimer par un graphique (fig. 5). La solubilité du chlorure de sodium est donnée par l’expression
et celle du chlorure de potassium par
Portons les quantités de chlorure de sodium en ordonnées, à partir de O de bas en haut, et les quantités de chlorure de potassium en abscisses, à partir du même point, de gauche à droite aux données indiquées correspondent les trois points C, A et B. Relions maintenant les points A et B au point C ; AC correspond à la saturation en chlorure de sodium pour des quantités croissantes de chlorure de potassium, et BC à la saturation en chlorure de potassium pour des quantités croissantes de chlorure de sodium. On comprend facilement ce qui va se passer lorsqu’on concentrera une solution : supposons que celle-ci ne soit pas saturée ; elle est représentée par un point c situé à l’intérieur de OACB dont la position indique la quantité des deux chlorures. Si l’on concentre la solution, ces quantités des deux sels (rapportées à 1 000 H2O) augmentent, mais leur rapport ne change pas ; ceci correspond à un déplacement en ligne droite du point figuratif qui s’éloigne de O, donc à un mouvement suivant cd dans le sens de la flèche. L’arrivée sur BC, en d, indique le commencent de la séparation du chlorure de potassium ; à partir de ce point, le déplacement du point figuratif change brusquement de direction, il se fait vers le point C en s’éloignant de B, dans le sens indiqué par la flèche. En C commence le dépôt simultané des deux sels, qui se continue jusqu’à dessiccation totale. La même chose se passera pour chaque dissolution des deux chlorures, et on arrivera toujours au même point C, que nous appellerons pour cette raison le point de cristallisation finale (Krystallisationsendpunkt).
Nous emprunterons à ce graphique le principe fondamental sur lequel nous nous appuierons pour les cas de cristallisation plus compliqués. Ce principe consiste en ceci que, lors de la cristallisation, la solution s’éloigne de plus en plus de la composition de celle qui ne contient que le corps qui cristallise et en est saturée. On comprend immédiatement ce qui arrivera si l’on fait l’inverse, c’est-à-dire si l’on ajoute de l’eau et le sel qui se déposerait pendant la concentration : la solution se rapproche de plus en plus de la solution saturée de ce sel unique, la proportion de l’autre sel à celui-ci diminuant indéfiniment.
Nous voyons dans la figure 5 quatre applications de ce principe. Si du chlorure de potassium se dépose, le point figuratif de la composition de la dissolution se déplace sur BC en s’éloignant du point B qui représente la saturation en chlorure de potassium ; si c’est le chlorure de sodium qui se dépose, le point figuratif se déplace sur AC et s’éloigne de A correspondant à la saturation en chlorure de sodium ; si les deux sels se déposent simultanément, le point figuratif est et demeure en C, car on comprend qu’il ne puisse se déplacer ni vers A ni vers B, ni dans aucune autre direction ; si rien ne se dépose, le point figuratif, qui occupait une position c, s’éloigne du point O qui correspond à l’eau pure. Tout ceci, qui nous paraît évident, nous donnera plus tard une indication utile. Nous allons passer maintenant à un cas plus compliqué.
Restons-en aux sels de l’eau de mer et considérons la proportion de ces sels rapportée à 100 molécules de chlorure de sodium :
Au mélange des chlorures de potassium et de sodium nous pourrions ajouter un troisième sel, le chlorure de magnésium, par exemple, mais nous arriverons plus vite au but en considérant tout d’abord les trois sels, chlorure de potassium, chlorure de magnésium et sulfate de magnésium et ne tenant compte que plus tard du chlorure de sodium qui est toujours en excès.
Procédant d’une façon systématique, nous avons d’abord la combinaison chlorure de potassium et chlorure de magnésium, deux sels de même acide, puis la combinaison chlorure de magnésium et sulfate de magnésium, deux sels de même base. Il nous faut encore, pour traiter le problème d’une façon générale, tenir compte du sulfate de potassium, que nous n’avons pas indiqué, mais qui peut se former aux dépens du chlorure de potassium et du sulfate de magnésium. La troisième combinaison serait ainsi sulfate de magnésium et sulfate de potassium, avec l’acide commun, et la quatrième, sulfate de potassium et chlorure de potassium, avec la base commune.
Le tableau suivant contient les données de solubilité qu’il faut connaître si l’on veut représenter les phénomènes au moyen d’un graphique ; les quantités des divers sels sont indiquées en équivalents, le chlorure de potassium, par exemple, en doubles molécules K2Cl2.
| Saturation en : | Pour 1 000 H2O en molécules | ||||
| K2Cl2 | MgCl2 | MgSO4 | K2SO4 | ||
| A. | Chlorure de potassium | 44 | — | — | — |
| E. | Chlorure de potassium et carnallite | 5,5 | 72,5 | — | — |
| F. | Chlorure de magnésium et carnallite | 1 | 105 | — | — |
| B. | Chlorure de magnésium | — | 108 | — | — |
| G. | Chlorure de magnésium et MgSO4. 6 H2O | — | 104 | 14 | — |
| H. | MgSO4. 7 H2O et MgSO4. 6 H2O | — | 73 | 15 | — |
| C. | MgSO4. 7 H2O | — | — | 55 | — |
| J. | MgSO4. 7 H2O et schœnite | — | — | 58,5 | 5,5 |
| K. | Sulfate de potassium et schœnite | — | — | 22 | 16 |
| D. | Sulfate de potassium | — | — | — | 12 |
| L. | Sulfate de potassium et chlorure de calcium | 42 | — | — | 1,5 |
La construction graphique facilite beaucoup la vue de l’ensemble. Nous pouvons conserver les deux axes rectangulaires du plan de la figure (fig. 6) et porter à partir de leur point d’intersection O, dans les quatre directions A, B, C et D les quantités respectives des quatre sels, chlorure de potassium, chlorure de magnésium, sulfate de magnésium et sulfate de potassium. Les quadrants compris entre ces axes correspondent aux quatre combinaisons énumérées des sels deux à deux ; nous utilisons ainsi quatre fois le mode de représentation adopté dans la figure 5. Dans trois des quadrants, la complication est un peu plus grande que dans la figure 5 à ceux de l’existence de certains composé définis : tandis qu’entre A, saturation en chlorure de potassium, et D, saturation en sulfate de potassium, il n’y a à considérer que la saturation pour les deux sels à la fois, en L, entre A et B, il y a, outre le chlorure de potassium et le chlorure de sodium, la carnallite MgCl2. KCl. 6 H2O, et il faut deux détermination, dont les résultats nous donnent les points E et F, correspondant à la saturation en carnallite et chlorure de potassium d’une part, en carnallite et chlorure de magnésium d’autre part. De même entre B et C, il y a, en GH, le sulfate de magnésium à 6 molécules d’eau, et entre C et D, en JK, la schœnite (SO4)2 MgK2. 6 H2O. La marche de la cristallisation se voit très facilement en appliquant le principe que nous avons exposé ; elle est indiquée par les flèches qui dans chacun des quadrants sont dirigées vers les points de cristallisation limite F, G, J et L.
Mais nous n’avons encore examiné qu’une partie des éventualités, car nous ne nous sommes pas occupés des solutions qui contiennent à la fois
du chlore, de l’acide sulfurique, du magnésium et du potassium. Nous
allons voir par un cas déterminé la façon de procéder dans l’étude expérimentale.
Partons, par exemple, du point L (fig. 6) correspondant à la saturation
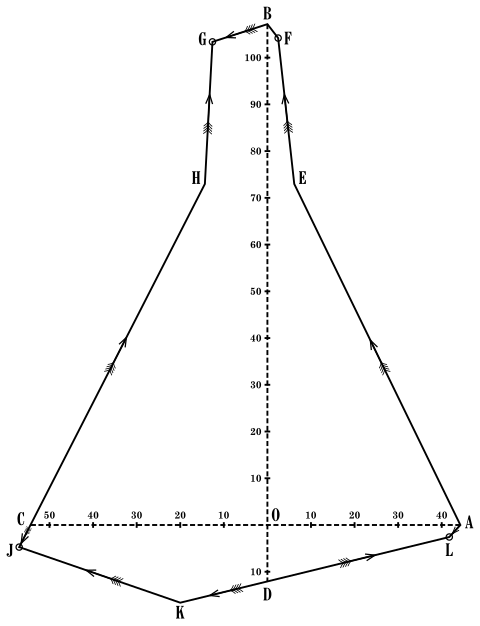
Fig. 6
en chlorure de potassium et sulfate de potassium. Maintenant la
température à 25° et ayant soin qu’un excès de ces deux sels soit toujours
en contact avec la solution, ajoutons du magnésium sous forme de chlorure
ou de sulfate. La solution s’enrichit en sels de magnésium tout en restant saturée de sulfate et de chlorure de potassium, jusqu’à ce qu’elle ne puisse
plus prendre de magnésium et qu’il s’en dépose un sel solide de magnésium ;
celui-ci, dans le cas actuel, est la schœnite (SO4)2 MgK2. 6 H2O. À partir de
ce moment, la quantité de magnésium n’augmente plus dans la solution,
et, si l’on continue à en ajouter, on ne fait qu’augmenter la schœnite
déposée ; la solution conserve sa composition, puisqu’elle est et reste saturée
en chlorure et sulfate de potassium ; cette composition correspond, comme
l’a montré l’analyse, d’une solution qui a été agitée longtemps à 25° avec
les trois sels, à la composition
Le problème se borne donc maintenant à l’étude et l’analyse de ces solutions de trois sels. A priori leur nombre peut être considérable si l’on considère les sept composés (K2Cl2 — MgCl2 — KSO4 — MgSO4, 6 H2O — MgSO4, 7 H2O — carnallite — schœnite) dont il a été question ; il serait 7.6.51.2.3 = 35. En réalité il n’en subsiste qu’un nombre moindre, et par une concentration systématique de la solution à 25°, en ayant soin d’enlever chaque fois les sels déposés, toutes les éventualités réalisables se montrent et se réduisent à quatre.
Après que le chlorure de potassium et la schœnite se sont déposés, il se forme d’abord comme troisième sel du sulfate de magnésium à 7 molécules d’eau, et, après l’enlèvement de celui-ci, on obtient du sulfate de magnésium et du chlorure de potassium, auxquels s’ajoute ensuite comme troisième sel du sulfate de magnésium à 6 molécules d’eau ; à partir de ce moment, c’est ce dernier et le chlorure de potassium qui cristallisent jusqu’à ce que la carnallite apparaisse ; cette dernière continue à se déposer en même temps que le sulfate de magnésium à 6 molécules d’eau, et enfin vient s’ajouter du chlorure de magnésium et toute la solution se dessèche en laissant ces trois derniers sels.
Ces résultats sont consignés dans le tableau suivant :
| Saturation en : | Pour 1 000 H2O en molécules | |||
| K2Cl2 | MgCl2 | MgSO4 | ||
| M. | Chlorure de potassium, sulfate de calcium, schœnite | 25 | 21 | 11 |
| N. | Chlorure de potassium, MgSO4. 7 H2O, schœnite | 9 | 55 | 16 |
| P. | Chlorure de potassium, MgSO4. 7 H2O, MgSO4. 6 H2O | 8 | 62 | 15 |
| Q. | Chlorure de potassium, carnallite, MgSO4. 6 H2O | 4,5 | 70 | 13,5 |
| R. | Chlorure de magnésium, carnallite, MgSO4. 6 H2O | 2 | 99 | 12 |
Il nous reste à porter ces nombres sur le graphique pour obtenir une vue d’ensemble du phénomène de la cristallisation.
Pour la représentation graphique, nous avons évidemment besoin d’un troisième axe correspondant à la troisième série de nombres : nous prendrons pour cela une verticale élevée en O, perpendiculaire aux deux axes primitifs. Il est commode de tracer les deux premiers axes sur une planche, aux divers point de laquelle on plante des aiguilles auxquelles on laisse des longueurs proportionnelles aux nombres de molécules du troisième corps contenues dans la dissolution. La figure 7 est la projection horizontale d’une modèle ainsi construit ; son contour coïncide évidemment avec celui de la figure 6. Les données ci-dessus ont fourni les points M, N, P, et R[2] et chaque couple de points correspondant à la saturation pour deux mêmes sels a été réuni par une ligne, par exemple, les deux points L et M correspondant tous deux à la saturation en sulfate et en chlorure de potassium.
Ces lignes divisent la figure en champs dont chacun correspond à la saturation par rapport à un sel déterminé :
| EQPNMLA | saturation | par | rapport | au chlorure de potassium. |
| EQRF | — | — | à la carnallite. | |
| FRGB | — | — | au chlorure de magnésium. | |
| MGHPQ | — | — | au MgSO4. 6 H2O. | |
| PHCJN | — | — | au MgSO4. 7 H2O. | |
| JKLMN | — | — | à la schœnite. | |
| KMLD | — | — | au sulfate de sodium. |
Le phénomène de la cristallisation est donné dans chaque champ par des lignes qui partent du point correspondant à la saturation par rapport au corps du champ seul ; ainsi dans le champ du chlorure de potassium, ces lignes partant du point A, etc.
Appliquons ceci à un cas déterminé et prenons une solution contenant une molécule-gramme de chlorure de magnésium et une molécule-gramme de sulfate de potassium. La première concentration sans cristallisation correspond à un mouvement qui éloigne le point figuratif de l’origine O des axes dans le sens vertical, jusqu’à la rencontre du champ du sulfate de potassium ; alors ce dernier sel se sépare, comme le montre l’expérience, ce qui correspond à un mouvement qui éloigne le point figuratif du point D, jusqu’à la limite KM, où la schœnite va cristalliser. Si l’on enlève les sels qui ont cristallisé et que l’on continue la concentration, la schœnite se dépose, ce qui correspond à un déplacement dans le champ de la schœnite suivant les lignes qui y sont tracées jusqu’à la limite MN, où commence le dépôt de chlorure de potassium. On voit, par les ligues qui de part et d’autre de MN représentent la marche de la cristallisation, qu’à partir de ce moment le point figuratif reste sur MN[3], jusqu’à ce que le sulfate de magnésium vienne à cristalliser, en N, etc. Maintenant, il est possible de calculer la quantité de sels déposée pour amener la solution en un point qui représente une composition donnée ; les résultats du calcul se sont trouvés d’accord avec ceux qu’a fournis l’expérience exécutée de plusieurs façons, de sorte que la figure 7 peut être utilisée comme moyen de représenter l’ensemble des phénomènes de cristallisation du mélange considéré.
- ↑ Annales de Chimie et de Phys., 1849 (3) 27, 92 et 172.
- ↑ Il est à remarquer que ce mode de représentation est indépendant de la façon dont on considère les sels de la dissolution, que ce soit, par exemple K2Cl2 et MgSO4 ou bien K2SO4 et MgCl2.
- ↑ C’est pourquoi les lignes limites, telles que MN, sont appelées lignes de cristallisation (Krystallisations bahnen) : il y en a quatre ; elles partent des points de cristallisation finale L, J, G, F et aboutissent à un point final commun R.
